ESTUDIO REVELA ASOCIACIÓN ENTRE LAS RESTAURACIONES DE AMALGAMAS DENTALES Y EL RIESGO DE LA ENFERMEDAD DE PARKINSON
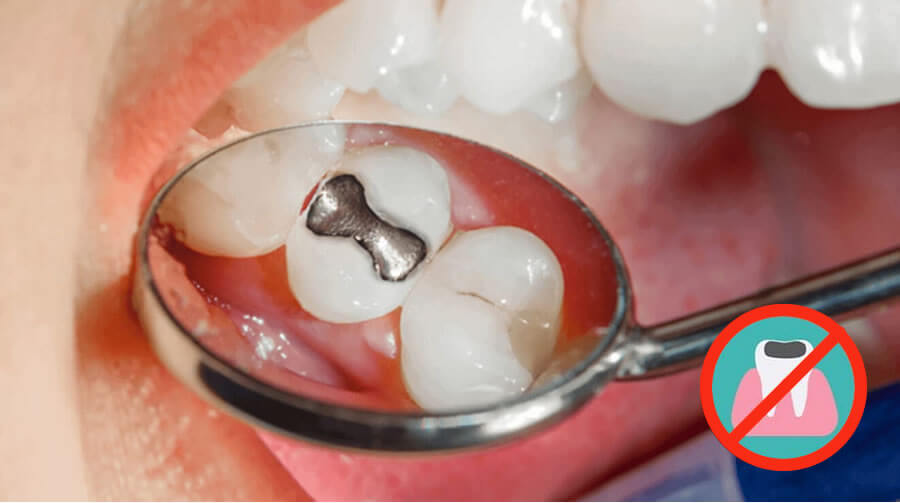
Los invitamos a leer este interesante artículo donde la Dra. Lourdes Chiok, odontóloga, nos muestra un estudio que revela que puede existir una relación entre las amalgamas dentales y el riesgo de desarrollar la enfermedad de Parkinson.
Qué son las amalgamas
Amalgama significa mezcla, siendo que las amalgamas dentales, son la mezcla de limaduras de diversos metales como la plata, el estaño, el cobre, algunas veces zinc y mercurio (el cual se encuentra en un estado líquido). Esta mezcla una vez preparada tiene una plasticidad que permite colocarla en la cavidad del diente.
Historia de las amalgamas
A comienzos del siglo XX el Dr. Greene Vardiman Black (considerado el padre de la Odontología) mejoró la composición de las amalgamas para hacerlas más estables, lo cual hizo que cada vez se usaran más en una época en la que solo existía como material restaurador el oro cohesivo (que tenía un precio más elevado).
Composición y peligro de las amalgamas en el cuerpo humano
Las amalgamas son fuente de mercurio elemental y metil-mercurio, el cual atraviesa la barrera hematoencefálica (Clarkson, 2002), además de pasar la barrera placentaria y entrar en el feto (Guzzi y La Porta, 2008).
El metil-mercurio es conocido como un potente neurotóxico (Aschner et al., 2007) y los vapores formados en la boca producto de la masticación, de la interacción con los microorganismos y de los diferentes alimentos que ingerimos pueden alcanzar el sistema nervioso central provocando estrés oxidativo, principal factor de enfermedades neurológicas. En niños, aún dosis bajas de exposición pueden tener efectos neurocognitivos (Karagas et al., 2012). Por todos estos motivos, el artículo que veremos a continuación, en el que se revela la asociación entre las restauraciones de amalgamas dentales y el riesgo de la enfermedad de Parkinson, es de gran importancia para la información de la población.
Introducción
Según este estudio, la amalgama dental, que contiene altas cantidades de mercurio, se ha utilizado comúnmente como material de obturación para tratamientos dentales, como restauraciones de cavidades, obturaciones radiculares retrógradas endodónticas y fabricación de muñones. En comparación con otros materiales de obturación dental, se cree que la amalgama tiene la ventaja de ser rentable, sostenible y resistente a la fuerza de masticación [1], además de ser fácil de manejar durante las operaciones. Por lo tanto, la amalgama dental sigue siendo actualmente uno de los materiales de restauración de dientes posteriores más utilizados [2]. Sin embargo, el uso de amalgama en odontología ha sido controvertido desde el siglo XIX.
Los estudios han demostrado que las restauraciones de amalgama dental liberan constantemente vapor de mercurio, lo que podría provocar la degeneración del sistema neurológico [3, 4]. Otros estudios han demostrado que la cantidad de caras con cavidades y dientes restaurados con relleno de amalgama tienen correlaciones positivas con el nivel de mercurio que se encuentra en la sangre y la orina de los pacientes [5–7].
La enfermedad de Parkinson (EP) es una enfermedad neurodegenerativa común caracterizada por la pérdida de células neuronales en la sustancia negra y, posteriormente, por la reducción de la secreción de dopamina. Se considera que el envejecimiento es un factor de riesgo importante para la EP [10], y se han informado otros factores de riesgo potenciales, como lesiones en la cabeza, infecciones, neurotoxinas, expresión génica y exposición ambiental a metales pesados (p. ej., mercurio) [11, 12 ].
Por lo tanto, este estudio se realizó utilizando la base de datos de investigación de seguros de salud nacional (NHIRD) en Taiwán (http://nhird. nhri.org.tw/en/index.htm) para evaluar si los pacientes de 55 años que tienen empastes de amalgama dental (s) tienen un mayor riesgo de adquirir PD posteriormente.
Materiales y métodos
Fuentes de datos
Las cohortes se seleccionaron entre los pacientes registrados en el NHIRD, que fue publicado con fines de investigación por los Institutos Nacionales de Investigación en Salud (NHRI) en 2008. A partir de 2007, el 98,4% de la población de Taiwán (aproximadamente 22,96 millones) era inscrito en el NHIRD. Los datos utilizados en el presente estudio se recuperaron de un conjunto de datos de 1 millón de inscritos seleccionados al azar en el NHIRD madre. Esto consistió en 1 millón de sujetos seleccionados al azar que representan aproximadamente el 4,5% de la población taiwanesa de todo el perfil de afiliados del NHI. No se encontraron diferencias significativas en edad y sexo entre el conjunto de datos de 1 millón de muestras aleatorias y los inscritos en el NHIRD madre [15]. Las características demográficas de los pacientes incluyeron números de identificación encriptados, sexo, fechas de nacimiento y muerte, y datos y procedimientos de diagnóstico.
Los datos de diagnóstico incluyeron las fechas de los procedimientos dentales, los códigos de diagnóstico y procedimiento de la Clasificación Internacional de Enfermedades, Novena Revisión, Modificación Clínica (ICD-9-CM) [16].
Selección y definición de casos
Los casos con empastes de amalgama incluidos en este estudio fueron pacientes con al menos un registro de código de procedimiento de empaste de amalgama (89001C–89003C y 89101C–89103C) entre 2000 y 2008. Los casos de PD comprendían pacientes a los que se les diagnosticó PD (ICD-9-CM código 3320) al menos una vez. Para mejorar la precisión diagnóstica y excluir el parkinsonismo secundario, se excluyeron los pacientes que tenían un diagnóstico de demencia, enfermedades cerebrovasculares, traumatismo craneoencefálico o trastornos psicóticos en el momento del diagnóstico de EP o 1 año antes [17].
Un total de 20.740 pacientes cumplieron los criterios de inclusión para nuestro estudio. Identificamos la cohorte de empastes de amalgama (n = 10 236) y la cohorte de relleno sin amalgama (n = 10 236) para el análisis de datos. Ambas cohortes fueron seguidas desde la fecha índice hasta el diagnóstico de EP, la muerte o el final del año 2008; lo que ocurriera primero.
Las comorbilidades relacionadas con la EP [18, 19], que incluyen diabetes (CIE-9-CM código 250), hipertensión (CIE-9-CM códigos 401–405), hiperlipidemia (CIE-9-CM código 272) y enfermedad cardiovascular (códigos CIE-9-CM 410–414 y 425–429) se registraron si se diagnosticaban 2 veces o más. Las enfermedades antes mencionadas fueron seleccionadas como comorbilidades porque están relacionadas con el síndrome metabólico [20], que puede promover enfermedades neurodegenerativas [21].
Análisis estadístico
Se compararon las características demográficas y las comorbilidades iniciales entre las cohortes de empastes con amalgama y sin amalgama. Se utilizaron las pruebas de McNemar para variables categóricas y la prueba t de muestras pareadas para variables continuas. Las variables categóricas como grupo de edad, sexo, comorbilidades, grupo de seguimiento y grupo de ICC se reportaron como porcentajes. Las variables continuas como la edad, el período de seguimiento y la puntuación de CCI se informan como media y desviación estándar. La tasa de incidencia (por 1000 años-persona) se calculó dividiendo el número de eventos de EP actual por los años-persona observados para cada paciente. Se utilizó el método de Kaplan-Meier para evaluar la probabilidad de supervivencia en EP entre las cohortes de relleno con amalgama y sin amalgama. Se utilizó la prueba de rangos logarítmicos para comparar sus diferencias. Luego se usaron modelos univariados y multivariados para calcular los cocientes de riesgos instantáneos (HR) y los intervalos de confianza (IC) del 95 % con los modelos de regresión de riesgos proporcionales de Cox. Los modelos multivariables se ajustaron por edad; comorbilidades de diabetes, hipertensión e hiperlipidemia; y CCI moderado. Todos los análisis se realizaron utilizando la versión 9.4 de SAS (SAS Institute Inc., Cary, NC, EE. UU.). La significancia estadística se definió cuando el valor de p fue <0,05.
Resultados y características demográficas
Según las características demográficas y las comorbilidades de la cohorte de relleno de amalgama (n = 10 236) y la cohorte de relleno sin amalgama (n = 10 236), la edad media fue de 64,39 ± 7,30 años en la cohorte de relleno de amalgama, y 64,29 años ±7,52 años en la cohorte de obturación sin amalgama. El número de pacientes masculinos y femeninos fue el mismo en ambas cohortes.
Los pacientes con empastes de amalgama tenían una mayor prevalencia de las 4 comorbilidades y puntuaciones medias de CCI en comparación con la cohorte sin empastes de amalgama (p<0,001). El tiempo medio de seguimiento para las cohortes de relleno con amalgama y sin amalgama fue de 5,15 y 5,22 años, respectivamente.
Riesgo de EP en la cohorte de relleno con amalgama
El número bruto de individuos con EP en las cohortes de relleno con amalgama y sin amalgama fue de 126 y 56, respectivamente. La incidencia global de EP fue significativamente mayor en la cohorte de relleno con amalgama que en la cohorte sin relleno de amalgama (2,35 frente a 1,04 por 1000 personas-año), con un HR ajustado (aHR) de 1,583 (IC del 95 % = 1,122–2,234, p = 0.0089).
La incidencia significativamente mayor de EP en la cohorte de relleno de amalgama se encontró en el grupo de edad de 65 a 74 años, pero no en los grupos de edad de 55 a 64 años y de 75 años. Para los pacientes que no tenían diabetes, la incidencia de EP (HR = 1,680, IC del 95 % = 1,171–2,410, p<0,01) también fue significativamente mayor en la cohorte de relleno con amalgama que en la cohorte sin relleno de amalgama. Se encontraron resultados similares en los pacientes sin hipertensión, hiperlipidemia, enfermedad cardiovascular, seguimiento de al menos 4 años y puntaje CCI moderado.
Por su parte, los pacientes hipertensos tenían un mayor riesgo de EP que los pacientes no hipertensos (HR = 1,645, IC 95% = 1,098-2,464, p = 0,0159).
La probabilidad de supervivencia libre de PD en la cohorte sin relleno de amalgama fue mayor que en la cohorte de relleno de amalgama de 2002 a 2008 (prueba de rango logarítmico, p<0,0001; Fig. 2).
Discusión
Hasta donde sabemos, este es el primer estudio de cohorte basado en la población a nivel nacional que evalúa el riesgo de desarrollar EP después de un empaste de amalgama dental. En nuestro estudio, el riesgo de EP aumentó en los pacientes con rellenos de amalgama restaurados en comparación con la cohorte sin relleno de amalgama independientemente del sexo o la edad. En el presente estudio, se seleccionaron 182 pacientes con EP (n = 126 y 56 para las cohortes de relleno de amalgama y control, respectivamente).
El mercurio elemental (Hg0) en la amalgama dental podría convertirse en metilmercurio (MeHg; CH3Hg+), que tiene una tasa de entrada más alta a través de la barrera hematoencefálica hacia el sistema nervioso central (SNC) que el mercurio inorgánico (Hg+ y Hg2+). Por lo tanto, MeHg se postula como un neurotóxico importante [25]. Los posibles mecanismos de formación de MeHg comienzan con la interacción del mercurio elemental con otros metales, creando una corriente galvánica, o la inmersión de la amalgama dental en cloruro de sodio o ácidos débiles de los alimentos.
Ambos procesos descritos provocan la corrosión oxidativa de la amalgama, liberando mercurio inorgánico en la cavidad oral. Previamente se demostró una correlación positiva entre la presencia de mercurio orgánico, presumiblemente MeHg, en la saliva y el relleno de amalgama [26]. Además, los microorganismos orales pueden convertir el mercurio inorgánico en MeHg [27].
Se ha descubierto que los altos niveles de MeHg en el SNC, que provocan estrés oxidativo, son un factor importante en las enfermedades neurológicas, incluida la apoptosis relacionada con la dopamina o el glutamato [28]. Además, MeHg tiene una fuerte afinidad por los nucleófilos como las moléculas de tiol y selenol, cuyas funciones son decisivas para la antioxidación y la homeostasis adecuada de las células neuronales y gliales [14, 29]. Por lo tanto, como se mencionó anteriormente, el estrés oxidativo y la interacción de MeHg con los nucleófilos podrían inducir neurotoxicidad y enfermedades neurodegenerativas como la EP.
Ciertas limitaciones deben ser consideradas en el presente estudio. En primer lugar, la base de datos no puede proporcionar ninguna otra información sobre la exposición a metales pesados, como los contaminantes del entorno residencial, la ocupación y los hábitos alimentarios, que son los factores hipotéticos de la EP. Además, la falta de registros médicos de la base de datos para evaluar las condiciones clínicas de los pacientes con EP definidos se debió a requisitos éticos. Nuestra cohorte mostró que la prevalencia de EP por 1.000.000 de personas fue de 681 en 2003 y 1530 en 2008. Esto sugiere que la sensibilidad diagnóstica de los criterios de nuestro estudio es aceptable.
En el presente estudio, el grupo de control no era un grupo real de no exposición porque estos individuos de control podrían haber estado expuestos a los empastes de amalgama antes del año 2000. Por lo tanto, los datos obtenidos para la cohorte de empastes de amalgama podrían haber resultado en una subestimación.
En tercer lugar, el diseño de este estudio involucró solo un período de observación de 7 años, que es la principal limitación del estudio. Aunque la mediana del tiempo de supervivencia en este estudio fue de 5,74 años en la cohorte de relleno de amalgama, a la mayoría de los sujetos se les diagnosticó EP dentro de los 2 años posteriores al relleno de amalgama.
Conclusiones
Los pacientes expuestos al empaste de amalgama dental tenían 1.583 veces más probabilidades de desarrollar EP posteriormente en comparación con sus contrapartes no expuestos.
Los presentes resultados no pudieron determinar una relación causal ni comparar el tiempo de aparición de la EP. Sin embargo, nuestros hallazgos mostraron que los ancianos que recibieron empastes de amalgama tenían un mayor riesgo de EP en el estudio de cohorte retrospectivo basado en la población de 9 años en Taiwán.
El estudio finaliza afirmando que “se necesitan futuros estudios de seguimiento a largo plazo para examinar las exposiciones ambientales, los hábitos dietéticos y definir con precisión el diagnóstico de la EP para una mejor comprensión de la asociación entre la amalgama dental y el desarrollo de la EP a fin de proporcionar información sobre las importantes implicaciones clínicas de esta enfermedad”.
Si desean leer el estudio completo, tanto en inglés como en español, aquí les dejamos los enlaces:
 |
 |
| Versión en español |
Versión en inglés |
Pueden contactar a la Dra. Lourdes Chiok a través del:
WhatsApp: 942 824 430
¡Esperamos que esta información les haya sido útil!
Recuerden seguir nuestras publicaciones de salud y bienestar a través de nuestras redes sociales @biendesalud, @perezalbela, y nuestra página web www.magnesol.pe.
Fuente de información y consulta:
Revista: Plos One 2016 DOI: 10.1371/journal.pone.0166552
Association between History of Dental Amalgam Fillings and Risk of Parkinson's
Disease: A Population-Based Retrospective Cohort Study in Taiwan.
Autores: Yung-Chuang Hsu, Cheng-Wei Chang, Hsin-Lin Lee, Chuan-Chung Chuang, Hsien- Chung Chiu, Wan-Yun Li, Jorng-Tzong Horng, Earl Fu.
Asociación entre las restauraciones de amalgama y el riesgo de enfermedad de Parkinson: Un estudio de cohortes retrospectivo basado en una población de Taiwán.
Referencias:
Clarkson, T.W., 2002. The three modern faces of mercury. Environ. Health Perspect. 110
(Suppl. 1), 11–23. https://doi.org/10.1289/ehp.02110s111.
Guzzi, G., La Porta, C.A., 2008. Molecular mechanisms triggered by mercury. Toxicology
244 (1), 1–12. https://doi.org/10.1016/j.tox.2007.11.002.
Aschner M, Syversen T, Souza DO, Rocha JB, Farina M. Involvement of glutamate and reactive oxygen species in methylmercury neurotoxicity. Braz J Med Biol Res. 2007; 40(3):285±91. PMID: 17334523
Karagas, M.R., Choi, A.L., Oken, E., Horvat, M., Schoney, R., Kamai, E., Cowell, W.,
Grandjean, P., Korrick, S., 2012. Evidence on the human health effects of low-level
methylmercury exposure. Environ. Health Perspect. 120 (6), 799–806. https://doi.
org/10.1289/ehp.1104494.
Referencias del estudio:
1. Correa MB, Peres MA, Peres KG, Horta BL, Barros AD, ¿Demarco FF. Amalgam or composite resin? Factors influencing the choice of restorative material. J Dent. 2012; 40(9):703–10. doi: 10.1016/j.jdent. 2012.04.020 PMID: 22546263
2. Clarkson TW. The three modern faces of mercury. Environ Health Perspect. 2002; 110 Suppl 1:11–23.
3. Satoh H. Occupational and environmental toxicology of mercury and its compounds. Ind Health. 2000; 38(2):153–64. PMID: 10812838
4. Bates MN, Fawcett J, Garrett N, Cutress T, Kjellstrom T. Health effects of dental amalgam exposure: a retrospective cohort study. Int J Epidemiol. 2004; 33(4):894–902. doi: 10.1093/ije/dyh164 PMID: 15155698
5. Bratel J, Haraldson T, Meding B, Yontchev E, Ohman SC, Ottosson JO. Potential side effects of dental amalgam restorations. (I). An oral and medical investigation. Eur J Oral Sci. 1997; 105(3):234–43. PMID: 9249190
6. Langworth S, Sallsten G, Barregard L, Cynkier I, Lind ML, Soderman E. Exposure to mercury vapor and impact on health in the dental profession in Sweden. J Dent Res. 1997; 76(7):1397–404. PMID: 9207773
7. Seidler A, Hellenbrand W, Robra BP, Vieregge P, Nischan P, Joerg J, et al. Possible environmental, occupational, and other etiologic factors for Parkinson’s disease: a case-control study in Germany. Neurology. 1996; 46(5):1275–84. PMID: 8628466
8. European commission: http://ec.europa.eu/health/scientific_committees/emerging/docs/scenihr_o_ 046.pdf
9. Rodriguez-Farre E, Ms. Scientific Committee S, Testai E, Bruzell E, De Jong W, Schmalz G, et al. The safety of dental amalgam and alternative dental restoration materials for patients and users. Regul Toxicol Pharmacol. 2016.
10. Hindle JV. Ageing, neurodegeneration and Parkinson’s disease. Age Ageing. 2010; 39(2):156–61. PMID: 20051606
11. Zorzon M, Capus L, Pellegrino A, Cazzato G, Zivadinov R. Familial and environmental risk factors in Parkinson’s disease: a case-control study in north-east Italy. Acta Neurol Scand. 2002; 105(2):77–82. PMID: 11903115
12. Allam MF, Del Castillo AS, Navajas RF. Parkinson’s disease risk factors: genetic, environmental, or both? Neurol Res. 2005; 27(2):206–8. doi: 10.1179/016164105X22057 PMID: 15829184
13. Clarkson TW, Magos L. The toxicology of mercury and its chemical compounds. Crit Rev Toxicol. 2006; 36(8):609–62. doi: 10.1080/10408440600845619 PMID: 16973445
14. Farina M, Avila DS, da Rocha JB, Aschner M. Metals, oxidative stress, and neurodegeneration: a focus on iron, manganese and mercury. Neurochem Int. 2013; 62(5):575–94. doi: 10.1016/j.neuint.2012.12. 006 PMID: 23266600
15. Hsu CC, Wahlqvist ML, Lee MS, Tsai HN. Incidence of dementia is increased in type 2 diabetes and reduced by the use of sulfonylureas and metformin. J Alzheimers Dis. 2011; 24(3):485–93. doi: 10. 3233/JAD-2011-101524 PMID: 21297276
16. Romano PS, Roos LL, Jollis JG. Adapting a clinical comorbidity index for use with ICD-9-CM administrative data: differing perspectives. J Clin Epidemiol. 1993; 46(10):1075–9; discussion 81–90. PMID: 8410092
17. Liu WM, Wu RM, Lin JW, Liu YC, Chang CH, Lin CH. Time trends in the prevalence and incidence of Parkinson’s disease in Taiwan: A nationwide, population-based study. J Formos Med Assoc. 2016; 115 (7):531–8. doi: 10.1016/j.jfma.2015.05.014 PMID: 26123636
18. Tang CF, Lu MK, Muo CH, Tsai CH, Kao CH. Increased risk of brain tumor in patients with Parkinson’s disease: a nationwide cohort study in Taiwan. Acta Neurol Scand. 2016; 134(2):148–53. doi: 10.1111/ ane.12524 PMID: 26508469
19. Hsu YT, Liao CC, Chang SN, Yang YW, Tsai CH, Chen TL, et al. Increased Risk of Depression in Patients with Parkinson Disease: A Nationwide Cohort Study. Am J Geriatr Psychiatry. 2015; 23 (9):934–40. doi: 10.1016/j.jagp.2014.10.011 PMID: 25529799
20. Hwang LC, Bai CH, Chen CJ. Prevalence of obesity and metabolic syndrome in Taiwan. J Formos Med Assoc. 2006; 105(8):626–35. doi: 10.1016/S0929-6646(09)60161-3 PMID: 16935763
21. Mattson MP. Roles of the lipid peroxidation product 4-hydroxynonenal in obesity, the metabolic syndrome, and associated vascular and neurodegenerative disorders. Exp Gerontol. 2009; 44(10):625–33. doi: 10.1016/j.exger.2009.07.003 PMID: 19622391
22. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987; 40(5):373–83. PMID: 3558716
23. Deyo RA, Cherkin DC, Ciol MA. Adapting a clinical comorbidity index for use with ICD-9-CM administrative databases. J Clin Epidemiol. 1992; 45(6):613–9. PMID: 1607900
24. Ngim CH, Devathasan G. Epidemiologic study on the association between body burden mercury level and idiopathic Parkinson’s disease. Neuroepidemiology. 1989; 8(3):128–41. PMID: 2725805
25. Aschner M, Syversen T, Souza DO, Rocha JB, Farina M. Involvement of glutamate and reactive oxygen species in methylmercury neurotoxicity. Braz J Med Biol Res. 2007; 40(3):285–91. PMID: 17334523
26. Leistevuo J, Leistevuo T, Helenius H, Pyy L, Osterblad M, Huovinen P, et al. Dental amalgam fillings and the amount of organic mercury in human saliva. Caries Res. 2001; 35(3):163–6. PMID: 11385194
27. Ferracane JL. Amalgam-derived mercury. Gen Dent. 1992; 40(3):223–9. PMID: 1499975
28. Nabi S. Toxic Effect of Mercury. Springer India; 2014.
29. Glaser V, Leipnitz G, Straliotto MR, Oliveira J, dos Santos VV, Wannmacher CM, et al. Oxidative stress-mediated inhibition of brain creatine kinase activity by methylmercury. Neurotoxicology. 2010; 31 (5):454–60. doi: 10.1016/j.neuro.2010.05.012 PMID: 20566354
30. Timonen P, Niskanen M, Suominen-Taipale L, Jula A, Knuuttila M, Ylostalo P. Metabolic syndrome, periodontal infection, and dental caries. J Dent Res. 2010; 89(10):1068–73. doi: 10.1177/ 0022034510376542 PMID: 20647498
31. Garton BJ, Ford PJ. Root caries and diabetes: risk assessing to improve oral and systemic health outcomes. Aust Dent J. 2012; 57(2):114–22. doi: 10.1111/j.1834-7819.2012. 01690.x PMID: 22624749
32. Saunders RH Jr., Meyerowitz C. Dental caries in older adults. Dent Clin North Am. 2005; 49(2):293– 308. doi: 10.1016/j.cden.2004.10.004 PMID: 15755406
33. Cullinan MP, Ford PJ, Seymour GJ. Periodontal disease and systemic health: status. Aust Dent J. 2009; 54 Suppl 1: S62–9.
34. Jawed M, Shahid SM, Qader SA, Azhar A. Dental caries in diabetes mellitus: role of salivary flow rate and minerals. J Diabetes Complications. 2011; 25(3):183–6. doi: 10.1016/j.jdiacomp.2010.07.001 PMID: 20801061
35. Brailsford SR, Shah B, Simons D, Gilbert S, Clark D, Ines I, et al. The predominant aciduric microflora of root-caries lesions. J Dent Res. 2001; 80(9):1828–33. PMID: 11926242
36. Hu SW, Yang LC, Chang HY. Factors associated with amalgam restorations in Taiwan. Br Dent J. 2002; 193(7):411–4. doi: 10.1038/sj.bdj.4801577 PMID: 12420015
37. Lu L, Fu DL, Li HQ, Liu AJ, Li JH, Zheng GQ. Diabetes and risk of Parkinson’s disease: an updated meta-analysis of case-control studies. PLoS One. 2014; 9(1):e85781. doi: 10.1371/journal.pone. 0085781 PMID: 24465703
38. Santiago JA, Potashkin JA. Shared dysregulated pathways lead to Parkinson’s disease and diabetes. Trends Mol Med. 2013; 19(3):176–86. doi: 10.1016/j.molmed.2013.01.002 PMID: 23375873
39. Towler MC, Hardie DG. AMP-activated protein kinase in metabolic control and insulin signaling. Circ Res. 2007; 100(3):328–41. doi: 10.1161/01.RES.0000256090.42690.05 PMID: 17307971
40. Wahlqvist ML, Lee MS, Hsu CC, Chuang SY, Lee JT, Tsai HN. Metformin-inclusive sulfonylurea therapy reduces the risk of Parkinson’s disease occurring with Type 2 diabetes in a Taiwanese population cohort. Parkinsonism Relat Disord. 2012; 18(6):753–8. doi: 10.1016/j.parkreldis.2012.03.010 PMID: 22498320
41. Teunissen CE, Lutjohann D, von Bergmann K, Verhey F, Vreeling F, Wauters A, et al. Combination of serum markers related to several mechanisms in Alzheimer’s disease. Neurobiol Aging. 2003; 24 (7):893–902. PMID: 12928047
42. Huang X, Chen PC, Poole C. APOE-[epsilon]2 allele associated with higher prevalence of sporadic Parkinson disease. Neurology. 2004; 62(12):2198–202. PMID: 15210882
43. Qiu C, Xu W, Fratiglioni L. Vascular and psychosocial factors in Alzheimer’s disease: epidemiological evidence toward intervention. J Alzheimers Dis. 2010; 20(3):689–97. doi: 10.3233/JAD-2010-091663 PMID: 20182015
44. Papapetropoulos S, Ellul J, Argyriou AA, Talelli P, Chroni E, Papapetropoulos T. The effect of vascular disease on late onset Parkinson’s disease. Eur J Neurol. 2004; 11(4):231–5. doi: 10.1046/j.1468-1331. 2003.00748.x PMID: 15061824
45. Lopez-Real A, Rey P, Soto-Otero R, Mendez-Alvarez E, Labandeira-Garcia JL. Angiotensin-converting enzyme inhibition reduces oxidative stress and protects dopaminergic neurons in a 6-hydroxydopamine rat model of Parkinsonism. J Neurosci Res. 2005; 81(6):865–73. doi: 10.1002/jnr.20598 PMID: 16015598
46. Burt BA. Epidemiology of dental diseases in the elderly. Clin Geriatr Med. 1992; 8(3):447–59.
47. SHOFU INC.: http://www.shofu.co.jp/global/contents/hp0004/index.php?No=4
48. Information from Ministry of Health and Welfare, Taiwan, R.O.C.: http://www.mohw.gov.tw/CHT/ DOMHAOH/DM1_P.aspx? f_list_no=189&doc_no=48300
24-01-2023

